|
Les molécules aussi peuvent être décrites à
l'aide de niveaux d'énergie de leurs électrons ; en
première approximation ces niveaux peuvent se
calculer par combinaison de ceux des atomes en
interaction.
Certaines réactions chimiques conduisent à la formation de molécules dans un état excité ; la désexcitation s'effectue dans certains cas avec émission de photons visibles. C'est le cas des réactions biologiques utilisées par les lucioles (“vers luisants”) ; c'est aussi le cas de la formation de l'oxygène singulet. |
| Cette
manipulation utilise un générateur de dichlore (obtenu
par exemple en versant une solution concentrée de HCl
sur des cristaux de KMnO4) et une solution
très basique de peroxyde d'hydrogène (mélange à parts
égales de H2O2 100 vol. et de
“lessive de soude” : solution de NaOH à 10 mol/L). remarque : il est préférable d'intercaler un flacon anti-retour, de procéder sous une hotte aspirante, de porter des gants... |
 |
| La
réaction (bilan) : Cl2 + 2 HO-
+ H2O2 ---> 2 Cl-
+ 2 H2O + O2* est suivie d'une désexcitation : O2* ---> O2 + photon (rouge). Le mécanisme est probablement : Cl2 + HO- ---> Cl- + ClOH ClOH + HO- ---> ClO- + H2O ClO- + HOOH ---> HOOCl + HO- HOOCl ---> HCl + O2* HCl + HO- ---> Cl- + H2O. |
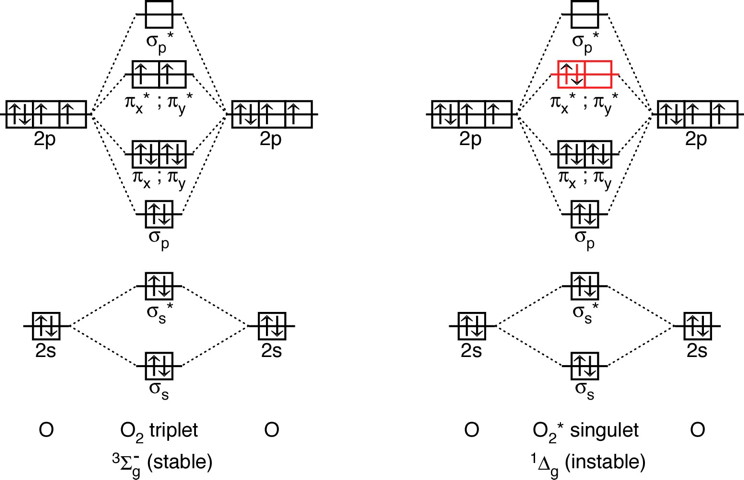
| Le diagramme des
niveaux d'énergie électroniques de O2 peut
être déterminé qualitativement par combinaison des
niveaux atomiques. D'après la règle de Hund, l'état stable correspond à deux électrons célibataires dans les orbitale pi* (le dioxygène est ainsi paramagnétique). Le dioxygène formé dans la réaction précédente est moins symétrique (et diamagnétique). |
 |