TRACÉ ET MODÉLISATION DE CARACTÉRISTIQUES - corrigé du TP2
1. Caractéristique d’une pile Daniell
• Tout dipôle électrocinétique est caractérisé par une relation
entre le courant qui le
traverse et la tension entre ses
bornes ; cette relation peut être exprimée sous forme d'équation ou
sous forme graphique.
• Les dipôles “linéaires” sont ceux dont la relation caractéristique
possède des propriétés de linéarité :
et/ou
.
Ceci comprend essentiellement les dipôles solutions d'équations
différentielles de la forme générale :
.
En régime continu, cela se limite à la forme “affine” :
, généralement notée avec les notations de Thévenin ()
ou de Norton () .
◊ remarque : en régime variable, la forme plus générale peut se
ramener à cette notation plus simple si on utilise des représentants
complexes.
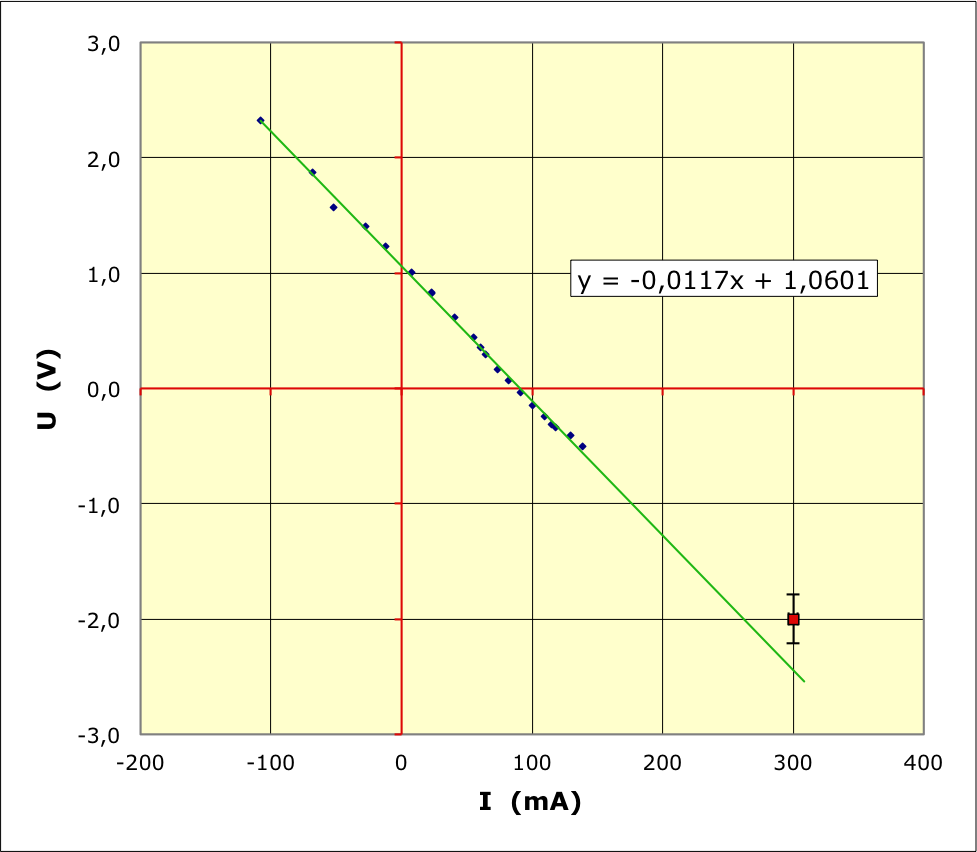
2. Tracé de la courbe “caractéristique” point par point
• Le tracé de la caractéristique montre qu'on obtient en assez bonne
approximation une droite ne passant pas par l'origine (forme
affine). Le fonctionnement correspondant peut être interprété en
trois parties.
• Pour
les électrodes sont à des potentiels
et
; ceci provoque l'oxydation des atomes de cuivre de
l'électrode (qui passent en solution sous forme d'ions
)
et la réduction des ions zinc de la solution (qui se déposent sur
l'électrode de zinc sous forme d'atomes
).
Ceci correspond à une recharge de la pile.
L'électrode est
donc l'anode (par définition : borne par laquelle entre le courant,
ce qui est associé à une oxydation) et l'électrode est
la cathode (par définition : borne par laquelle sort le courant, ce
qui est associé à une réduction). Le courant est ainsi
négatif (en convention générateur).
L'électrode de cuivre peut être qualifiée de “borne (+)” et
l'électrode de zinc de “borne (-)” puisque cela correspond à l'ordre
de leurs potentiels :
pour .
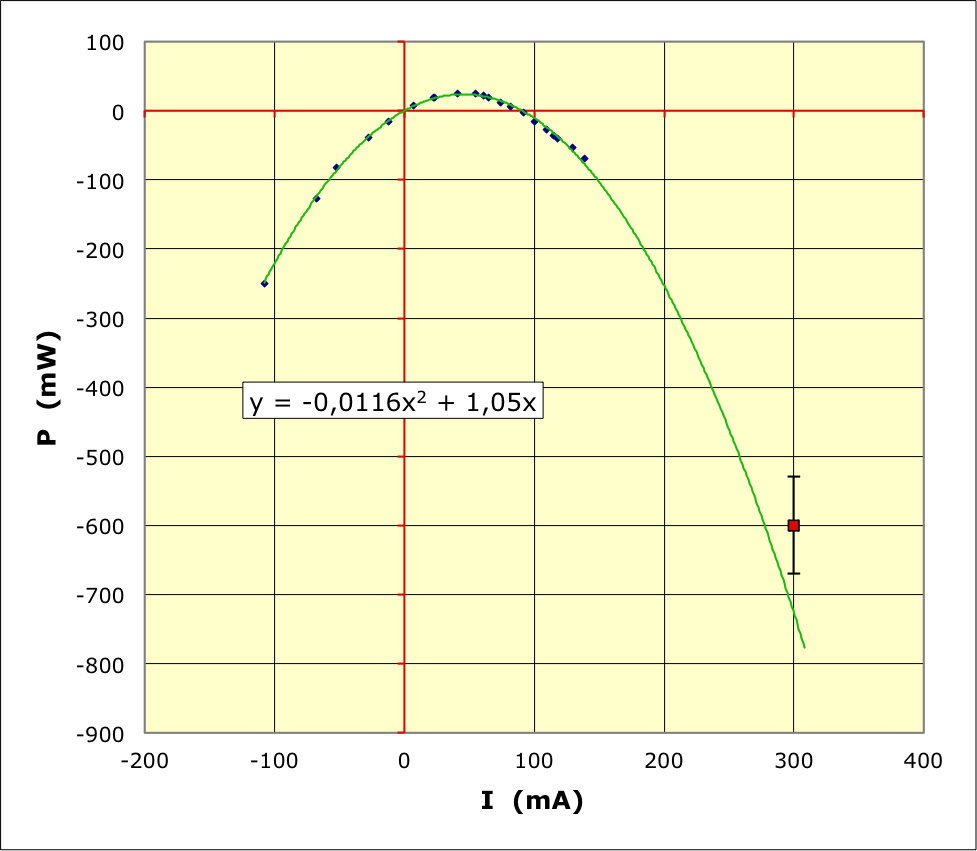
En convention générateur, la puissance électrique fournie par la
pile au circuit est :
(
est reçue par la pile). La puissance “générée” est
(dans ce cas
correspond à de l'énergie électrique transformée en énergie chimique
: recharge de la pile) ; la puissance consommée par effet Joule
correspond à
(énergie “perdue” dans la pile, non disponible pour la recharge).
• Pour
les électrodes sont à des potentiels
et
; ceci provoque l'oxydation des atomes de zinc de l'électrode
(qui passent en solution sous forme d'ions
)
et la réduction des ions cuivre de la solution (qui se déposent sur
l'électrode de cuivre sous forme d'atomes
).
Ceci correspond à une décharge de la pile.
L'électrode est
donc l'anode (par définition : borne par laquelle entre le courant,
ce qui est associé à une oxydation) et l'électrode est
la cathode (par définition : borne par laquelle sort le courant, ce
qui est associé à une réduction). Le courant est ainsi
positif (en convention générateur).
L'électrode de cuivre peut être qualifiée de “borne (+)” et
l'électrode de zinc de “borne (-)” puisque cela correspond à l'ordre
de leurs potentiels :
pour .
En convention générateur, la puissance électrique fournie par la
pile au circuit est :
. La puissance “générée” est
(dans ce cas
correspond à de l'énergie chimique transformée en énergie électrique
: décharge de la pile) ; la puissance consommée par effet Joule
correspond à
(une partie de l'énergie générée est “perdue” et non transmise au
circuit).
• Pour
les électrodes sont à des potentiels
et
; ceci correspond encore à une décharge de la pile, mais dans
des conditions “anormales” : sur-décharge forcée par le générateur
annexe (très forcée pour
).
L'électrode est
donc l'anode (par définition : borne par laquelle entre le courant,
ce qui est associé à une oxydation) et l'électrode
est la cathode (par définition : borne par laquelle sort le courant,
ce qui est associé à une réduction). Le courant
est ainsi positif (en convention générateur).
L'électrode de cuivre peut être qualifiée de “borne (-)” et
l'électrode de zinc de “borne (+)” puisque cela correspond à l'ordre
de leurs potentiels :
pour .
En convention générateur, la puissance électrique fournie par la
pile au circuit est :
(
est reçue par la pile et gaspillée en effet Joule). La
puissance “générée” est
(dans ce cas
correspond à de l'énergie chimique transformée en énergie électrique
: décharge de la pile gaspillée en effet Joule) ; la puissance
consommée par effet Joule correspond à
(plus d'énergie “perdue” que d'énergie générée).
3. Mesure d’une f.e.m. par la méthode d’opposition
• La caractéristique obtenue précédemment correspond à :
;
;
;
.
La mesure de la f.e.m. par méthode d'opposition est en attente de
données fournies par les étudiants...